查詢時請注意選擇相應的產品編號
| 實驗室制取二氧化硫的發生裝置的反應原理 | |||
|---|---|---|---|
|
實驗室制取二氧化碳時,為什么最好選用稀鹽酸。答:如果用稀硫酸和大理石或石灰石反應,有關化學方程式為:CaCO3+H2SO4=CaSO4+H2O+CO2↑,結果生成微溶性固體硫酸鈣,它覆蓋在大理石或石灰石表面,使酸與大理石或石灰石脫離接觸,導致反應太緩慢。如果用硝酸與大理石或石灰石反應,由于硝酸是一種不穩定性的酸,在見光或受熱時易分解:4HNO3=4NO2↑+O2↑+2H2O,從而使制得的CO2中混有NO2和O2等雜質。
如果用濃鹽酸和大理石或石灰石反應,由于濃鹽酸具有揮發性,使制得的CO2中混有較多的氯化氫氣體。用稀鹽酸和大理石或石灰石反應,所得CO2氣體平穩,氣體又較為純凈,所以選用稀鹽酸制CO2最合適。
實驗室制取二氧化碳裝置,需要哪些儀器使用時應注意什么事項?答:儀器有廣口瓶(平底燒瓶、錐形瓶等)、長頸漏斗、雙孔橡皮塞、導管、集氣瓶。用時應注意的事項有:(1)要用鑷子夾取石灰石或大理石。裝入廣口瓶(平底燒瓶、錐形瓶等)時要注意“一橫、二放、三豎”。(2)插入廣口瓶(平底燒瓶、錐形瓶等)內的導管不能伸入液面以下,也不宜過長,只需剛剛露出塞子即可,這樣才能有利于氣體導出。(3)稀鹽酸應從長頸漏斗加入,長頸漏斗的下端管口要伸入液面以下,防止反應生成的氣體從長頸漏斗逸出。 (4)不能用酒精燈加熱制CO2。
SO2的實驗室制法:(1)反應原理:Na2SO3+H2SO4(濃)=Na2SO4+H2O+SO2↑(2)實驗裝置:制Cl2裝置(但不需加熱)(3)注意事項:①由于SO2易溶于水,所以應選用濃H2SO4和Na2SO3(s)反應,反應是在固體和液體之間通常Na2SO3(s)為粉末狀,為控制反應速率,濃H2SO4應從分液漏斗中逐滴滴下.②濃鹽酸是不能采用的,因為其中含有大量的水(常溫常壓下,質量分數最大的濃鹽酸為45%的濃鹽酸),否則會有大量的SO2溶解在水中.③18.0mol·L-1的濃H2SO4(即質量分數為98%的濃H2SO4)也不能采用,因為其中缺少水分,硫酸并未電離,仍以分子形式存在,而Na2SO3(s)與H2SO4的反應是在H2SO4電離成離子的狀態下才能順利進行的.故通常采用體積比為1∶1的濃H2SO4.④Na2SO3(aq)不宜采用,因為其中含有大量水,開始階段主要生成HSO用氫氧化鈉還是氫氧化鈣,用氫氧化鈉了.氫氧化鈣是微溶于水,濃度很小,不能充分吸收的。本文由中藥標準對照品研究中心發布.氫氧化鈉濃度很大啊,能夠充分吸收加熱濃氨水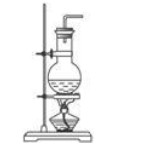 濃氨水與固體氫氧化鈉或生石灰混合 濃氨水與固體氫氧化鈉或生石灰混合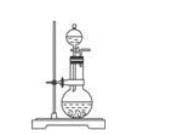 氯化銨和熟石灰混合加熱 氯化銨和熟石灰混合加熱
還有一種方法用品:圓底燒瓶(250ml)、玻璃導管、滴液漏斗、雙孔塞、集氣瓶、玻璃片、量筒、玻璃棒。亞硫酸鈉、濃硫酸、氨水、大燒杯、品紅溶液、紅色鮮花、藍色石蕊試液。
原理:實驗室里一般用銅跟濃硫酸或強酸跟亞硫酸鹽反應,制取二氧化硫。二氧化硫跟水化合生成亞硫酸,很不穩定,易分解。二氧化硫還能跟某些有色物質化合生成無色物質,具有漂白性。
準備和操作:1.二氧化硫的制取亞硫酸鹽跟硫酸反應可制得較純的二氧化硫。例如Na2SO3+H2SO4=Na2SO4+H2O+SO2↑在一個250毫升的圓底燒瓶里盛亞硫酸鈉14克,分液漏斗里盛濃硫酸,裝置如圖7-70所示。(見圖)實驗開始時,將濃硫酸逐滴加入燒瓶里,立即有二氧化硫氣體發生,不需加熱。當亞硫酸鈉全部被酸浸濕而發生氣體的速度減慢時,可以微微加熱,以加速反應的進行。二氧化硫容易跟水反應,所以要用向上排空氣法收集。用玻璃棒蘸氨水放在瓶口,如果出現濃厚的白煙,表示二氧化硫已收集滿。二氧化硫是一種有刺激性氣味的有毒氣體,勿使它逸散出來污染空氣。標準品
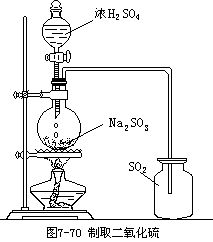 實驗室常見的制法:用濃硫酸與銅反應,工業制法:1、原料:黃鐵礦、空氣、濃硫酸2、原理:〔1〕沸騰爐:4FeS2+11O2=2Fe2O3+8SO2〔條件是煅燒〕 〔2〕接觸室:2SO2+O2=2SO3(在500攝氏度的條件下V2O5作催化劑) 〔3〕吸收塔:SO3+H2O=H2SO4 |
| 上一篇:長期接觸實驗室化學試劑會影響生育嗎? | 下一篇:環境保護部標準樣品研究所網站標準樣品購買 |
|---|
無法在這個位置找到: xy/left.htm
